IL METABOLISMO DEL FRUTTOSIO
Il fruttosio stimola la lipogenesi (cioè fa ingrassare), oppure no?
La risposta secca a tutto ciò è: dipende dal contesto metabolico-energetico in cui avviene la sua somministrazione. In certi momenti favorisce la lipogenesi (processi che presiedono alla sintesi dei grassi), in altri momenti, invece, non la favorisce.
Tuttavia, per capire meglio quali condizioni stimolano la lipogenesi e quali altre no, non è possibile fare a meno di vagliare le componenti biochimico-metabolico-enzimatiche che agiscono da discriminanti sui differenti destini metabolici dell’esoso in questione, appunto il fruttosio.
Potenzialità glicogenosintetiche epatiche e muscolari del fruttosio
L’ESOCINASI, enzima glicolitico, come suggerisce il suo nome non è substrato-specifico, cioè agisce in generale su tutti gli zuccheri a 6 atomi di carbonio (esosi).
Reagisce molto efficientemente con il glucosio nel plasma e nei tessuti ed anche se catalizza la fosforilazione di fruttosio, quest’ultimo substrato non ha un elevata affinità per tale enzima, infatti presenta un’affinità inferiore di 20 volte rispetto a quella estrinsecata, sempre per esso, dal glucosio. Pertanto, per il metabolismo (in direzione catabolica) del fruttosio risulta necessaria l’attività dello specifico enzima “fruttocinasi” necessario a far entrare il fruttosio nella sequenza glicolitica attraverso la catalizzazione della reazione che da fruttoso conduce a fruttoso-1-fosfato. La fruttocinasi è presente nel fegato e non nei muscoli1.
Questo è il primo dei motivi per il quale il fruttosio introdotto con la dieta non è il substrato elettivo per la glicogenosintesi muscolare.
Più precisamente l’incapacità del fruttosio nell’essere polimerizzato a glicogeno “muscolare” e’ legata al limite rappresentato dalla specificità enzimatica substrato-anatomica sulla quale poggia la sua fosforilazione a fruttoso-1-fosfato, necessaria ad arrivare, dopo una lunga serie di reazioni che procedono in senso neoglucogenico, a glucosio-1-fosfato (che rappresenta il punto di partenza per la formazione di molecole UDP-glucoso, prima, e loro annessione, poi, all’unità di glucosio terminale dell’estremità non riducente della catena di glicogeno, per l’evolversi del processo glicogenosintetico sul polisaccaride).
Oltre a tutto ciò – e forse trattasi anche della discriminante più importante circa il tessuto target del destino metabolico del fruttosio – si consideri che il fruttosio è soggetto al veicolamento epatico, fondamentalmente perché la capacità di trasportare fruttosio è solo prerogativa dei trasportatori di membrana: “GLUT 2” e “GLUT 5” (quest’ultimo si trova in elevate concentrazioni negli spermatozoi umani maturi); ed i GLUT 2 trovano elevata espressione nel fegato ed altri organi (rene) ma non nel muscolo2.
Quindi tre sono i motivi per i quali il fruttosio non riveste un ruolo primario quale substrato elettivo alla glicogenosintesi muscolare:
1) Mancanza a livello muscolare del suo enzima specifico d’ingresso nella sequenza glicolitica: (fruttocinasi).
2) Scarsa affinità per l’enzima esocinasi.
3) Mancanza di GLUT 2 a ridosso del sarcolemma, ovvero la membrana plasmatica del miocita2.
Fruttosio e potenzialità lipogeniche
Data la sede anatomica d’elezione per il metabolismo del fruttosio, la predisposizione del fruttosio nel convertirsi in glicogeno epatico è anche funzione dell’elevata attività della fruttocinasi – all’interno del fegato – che mette a disposizione più velocemente (rispetto a quanto è in grado di fare la glucocinasi per il d-glucoso) intermediari della glicolisi che – in presenza di scorte di glicogeno epatico non sature – convergono verso il processo glicogenosintetico.
Pertanto, il momento in cui tali scorte non risultano sature è sicuramente al mattino per via dell’utilizzo di glucosio ematico da parte del Sistema Nervoso Centrale che – per l’assenza di somministrazione esogena di fonti glucidiche durante la fase di riposo notturno – lo attinge dal glicogeno epatico depapeurandolo significativamente.
In tali circostanze la somministrazione di fruttosio ha un razionale e, pertanto non supporta la sintesi di acidi grassi e trigliceridi.
Nel prosieguo dell’articolo vedremo quali interventi biochimici, chiamati in causa dal fruttosio, stimolano i processi lipogenetici a livello del fegato. Più precisamente, si vedrà come a parità di somministrazione glucidica assoluta, questa avrà una maggiore tendenza lipogenetica quando derivi in parte da fruttosio e sia somministrata nella seconda parte della giornata.
In presenza di scorte epatiche di glicogeno, il metabolismo del fruttosio stimola i processi liposintetici su più livelli: gioca un ruolo importante nella variazione degli equilibri relativi alla concentrazione di substrato glucidico (glucosio), necessaria all’attivazione enzimatica glucoso-specifica (glucocinasi) per l’ingresso nella sequenza glicolitica;
nonché nel determinare variazioni dell’ambiente biochimico cellulare per le quali i prodotti del processo glicolitico, invece di entrare nel ciclo di Krebs per formare in ultima analisi ATP, anidride carbonica ed acqua, risultano il substrato d’elezione per il complesso dell’acido grasso-sintasi.
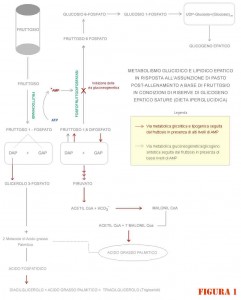
1) L’attività della fruttocinasi non subisce modulazioni allosteriche negative, pertanto la sua attività continua ininterrotta finché vi è fruttosio disponibile: tale attività, che come abbiamo visto nel fegato è spiccata, porta ad una massiccia deplezione di ATP. La deplezione di ATP, a sua volta, porta ad una perdita selettiva di magnesio e quindi diminuzione della fosforilazione ossidativa ed accumulo di AMP3.
Va notato come l’elevato consumo di ATP per l’esaltata attività fosforilasica della fruttocinasi porta a perdita selettiva di Mg da fegato e rene inducendo danni in quei tessuti che sono deputati alla metabolizzazione del fruttosio5. Pensateci bene prima di acquistare fruttosio puro per consumarlo come tale!
2)L’attività della fruttocinasi è superiore rispetto a quella dell’aldolasi che converte il fruttosio 1- fosfato in Gliceraldeide 3-fosfato e Diidrossiacetone 3-fosfato.
L’alterato equilibrio tra la velocità di sintesi e degradazione del fruttosio 1-fosfato porta inevitabilmente ad un suo accumulo4. Ciò si riverbera in una ulteriore stimolazione del processo glicolitico per attivazione della glucocinasi (vedi inserto glucocinasi, in basso alla fine dell’articolo), e data la depressa via della fosforilazione ossidativa per i motivi summenzionati il destino del prodotto finale del metabolismo degli zuccheri (Acetil CoA) sarà più favorevolmente deputato ad essere utilizzato quale substrato “primer” per eventi acido grasso-biosintetici che non per quelli ossidativi.
3) L’accumulo di AMP non consente ai sottoprodotti del metabolismo del fruttosio in comune con quelli del glucosio di procedere in senso gluconeogenico (figura 1) ma solo nella direzione glicolitica. E per le ragioni appena enunciate, l’acetil CoA derivante seguirà la via del complesso dell’acido grasso sintasi.
Inoltre, il fegato metabolizza molto più velocemente il fruttosio rispetto al glucosio, per motivi legati all’affinità degli specifici enzimi catalitici sui substrati glucidici e per l’affinità dei trasportatori “GLUT 2” verso gli stessi nel captarli dal flusso ematico e renderli disponibili all’interno del fegato per il loro metabolismo.
I “GLUT 2 presentano bassa affinità per il glucosio ( cioè hanno “Km” elevato, tra i 15 ed i 20 mM), quindi il glucosio non entra nell’epatocita a meno che non ve ne siano elevatissime concentrazioni plasmatiche da giustificare l’ingresso dello zucchero nel fegato.
Questo meccanismo è verosimilmente proteso verso il mantenimento di una certo livello basale di zuccheri nel sangue, al fine di garantire sempre un certo grado di efficienza nella somministrazione del substrato energetico di pronto utilizzo energetico per l’SNC (Sistema Nervoso Centrale), le emazie, il rene, la retina, la placenta ed il cuore – per i quali l’ingresso cellulare di glucosio è garantito dai GLUT 1 ad elevatissima affinità (Km= 1-2 mM)2.
A ciò si aggiunga e si abbini il fatto che la glucocinasi per il metabolismo del glucoso possiede anch’essa un Km elevato che esprime bassa affinità per il glucosio, e cioè che elevate quantità di glucosio sono necessarie per l’attivazione enzimatica glucoso-specifica epatica (glucocinasi). Invece il fruttosio viene veicolato al fegato e metabolizzato molto più velocemente grazie all’alta affinità dei GLUT 2 per l’ingresso dell’esoso e della fruttocinasi per lo stesso.
In virtù di tali conoscenze, e consci del fatto che lo stile nutrizionale di chi si alimenta in modo equilibrato prevede un protocollo di somministrazione frequente dei pasti nell’arco della giornata – dove i glucidi, per quanto limitati, sono sempre presenti e, pertanto, le scorte di glicogeno epatico non subiscono lo stesso livello di depapeuramento delle fasi di digiuno notturno -, è auspicabile evitare qualsiasi forma glucidica che contenga fruttosio durante le fasi serali o almeno limitare quanto possibile il livello del loro introito.
Fruttosio vs Glucosio nella finestra del pasto post-allenamento pesi
Ancora più attenzione deve essere dedicata (riferito agli atleti) alla fase integrazionale del periodo post allenamento in funzione di alcune considerazioni biochimiche chiave, quindi discriminanti sulla selezione del substrato glucidico da introdurre.
Sulla scorta delle mie esperienze dirette (anche in relazione alla preparazione per il “Tournament of Champions” NPC del 2011), in seno alla qualità degli alimenti glucidici facenti parte del pasto da consumare nell’immediata fase successiva ad allenamento vigoroso coi pesi, alimenti a base di fruttosio sono stati abbandonati per prediligere quelli a base di glucosio, derivante come tale (da assunzione diretta di glucosio) o da degradazioni enzimatiche a partire da amido (patate), in questo caso (cioè quello tipico del post allenamento) introdotto da fonti ad alto indice glicemico.
Il motivo di tali scelte è favorire i processi di sintesi proteica, il repletamento ottimale delle scorte di glicogeno muscolare, il recupero tra gli allenamenti – soprattutto evitando che tali eventi siano accompagnati da un parallelo incremento del tessuto adiposo.
Il razionale dietro il nesso legante assunzione di fruttosio e lipogenesi nel contesto “post-allenamento pesi” è relegato ad una precisa tappa di reazione enzimatica, che, procedendo in senso neoglucogenico a partire da intermediari della glicolisi messi a disposizione dal catabolismo del fruttosio, è catalizzata in modo irreversibile (ovvero l’enzima che catalizza tale tappa in senso gluconeogenico è diverso da quello che la catalizza in senso glicolitico) da uno specifico enzima.
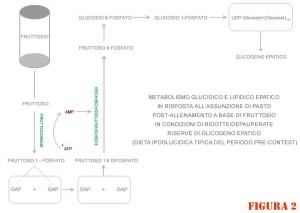
Tale reazione enzimatica avviene ad opera della “fruttoso difosfatasi” (figura 2) che catalizza la trasformazione di fruttoso-1,6-difosfato a fruttoso-6-fosfato attraverso la rimozione del gruppo 1-fosfato.
Poi, da qui, si procede in modo reversibile verso il glucosio-6-fosfato e ancora verso il glucosio-1-fosfato per continuare con le tappe glicogenosintetiche.
L’enzima fruttoso difosfatasi è allosterico, cioè è modulato in via positiva e negativa da specifici stimoli (modulatori allosterici positivi e negativi rispettivamente).
Alti livelli di AMP (che si presentano quando le scorte di glicogeno sono piene o poco depapeurate, e viceversa avviene nel caso di basse scorte di glicogeno epatico) inibiscono l’attività catalitica dell’enzima e sono indice di bassa carica energetica cellulare.
La fase post-allenamento pesi è caratterizzata da una deplezione delle scorte di glicogeno muscolare.
Le scorte di glicogeno epatico vengono intaccate per fornire glucosio libero per i muscoli in attività, solo quando questi non possono più attingere dal glicogeno muscolare poiché depapeurato.
Questo evento normalmente non è enfatizzato durante le fasi di allenamento tipiche di periodi lontano dalle gare o da regimi nutrizionali iper/normoglucidici.
Ciò perché il contesto nutrizionale quotidiano ed il pasto post allenamento sono sufficienti per repletare i livelli di glicogeno muscolare nella misura necessaria per fornire il “combustibile” durante lo sforzo fisico submassimale anaerobico-lattacido, senza (o con il minimo) intervento di altre fonti di riserva glucidica.
Si ricorda che i livelli di glicogeno muscolare sono all’incirca 3 volte superiori rispetto a quelli epatici – quindi, il glicogeno epatico interviene solo in casi di emergenza glucidica (ipoglicemia).
Ne consegue che, per quanto le scorte di glicogeno muscolare possano essere considerevolmente ridotte nel corso di un allenamento, il glicogeno epatico lo è di meno e quindi la somministrazione di fruttosio non trova una razionale collocazione in tale finestra temporale, quando insita in un contesto dietetico quotidiano iper/normoglucidico.
In tale contesto, la quantità e la fonte della somministrazione glucidica rappresentano la variabile dipendente condizionante il potenziale lipogenico del suo destino metabolico.
L’introduzione di fonti di glucosio e non di fruttosio in questa finestra metabolico-temporale presenta un triplice vantaggio:
- favorisce la risintesi di glicogeno muscolare grazie al basso Km d’ingresso cellulare di cui sono dotati i “GLUT 4” a livello muscolare, e l’altrettanto basso Km di cui è dotato l’esocinasi che a livello muscolare fa entrare nella via glicolitica (per poi convergere verso quella glicogenosintetica) il glucosio;
- scongiura la liposintesi a livello del tessuto adiposo bruno. Nonostante gli adipociti siano anch’essi dotati di GLUT 4 e di un’ affinità per il glucosio al pari di quelli presenti sul sarcolemma muscolare, il concerto sinergico tra stimolazioni meccaniche e metaboliche indotte dall’allenamento pesi (contrazione muscolare, impoverimento delle riserve di glicogeno muscolare) ed ormonali (secrezione insulinemica in risposta all’ingresso di glucosio) agenti sulla muscolatura striata scheletrica, determina una più elevata espressione dei GLUT 4 nonché velocità di traslocazione dal reticolo sarcoplasmatico al sarcolemma prevalendo, pertanto, sulla capacità di uptake del glucosio da parte dei GLUT 4 dislocati sugli adipociti5.
- non favorisce la liposintesi epatica.
I GLUT 2 presenti a livello fegato presentano un Km per il glucosio pari a 15-20 mM. Ciò significa che il livello ematico di glucosio necessario per attivare il suo trasporto all’interno del fegato deve essere compreso tra 270mg/dl e 360mg/dl. E’ un valore assai improbabile (nei soggetti senza alterazioni del metabolismo glucidico) anche quando si assumono quantitativi glucidici pari a 150g e ad alto indice glicemico. Invece, il fruttosio riesce ad entrare nel fegato per anche per concentrazioni glicemiche inferiori dato il diverso tipo di trasportatore ad alta affinità (GLUT 2) che ne favorisce la sua diffusione facilitata.
Quindi, nel contesto di una dieta iperglucidica (lontano dalla fase pre-gara), una valida scelta della fonte glucidica per il pasto post allenamento potrebbe essere rappresentata da glucosio oppure da patate (considerato anche il PRAL favorevolmente negativo di queste ultime).
Tutt’altro discorso, invece, vale per lo stato di costante e progressivo depapeuramento del glicogeno epatico a fronte di allenamenti anaerobico-lattacidi portati avanti in un contesto nutrizionale sensibilmente ipoglucidico (come quello pre-contest antecedente una gara di bodybuilding).
In questo caso, il contesto nutrizionale non è in grado di repletare a sufficienza le scorte di glicogeno muscolare ne epatico: quest’ultimo va incontro ad un impoverimento sistematico, per rendere disponibile glucosio al circolo sistemico per il metabolismo cerebrale quanto muscolare e degli altri organi.
In queste condizioni, l’introduzione di fruttosio nel pasto post-allenamento trova il suo fondamento razionale: l’attività della fruttocinasi è più spiccata di quella della glucocinasi, quindi il fegato riesce a metabolizzare il fruttosio prima del glucosio; come detto, l’attività della fruttocinasi è superiore a quella dell’aldolasi con conseguente accumulo di fruttosio 1-fosfato. Il fruttosio 1-fosfato attiva la glucocinasi ma non la fosfofruttocinasi e questo particolare, in presenza di basi livelli di glicogeno epatico, stimola preferibilmente il processo glicogenosintetico mettendo un blocco metabolico ai processi neoglucogenici derivanti anche dal catabolismo proteico4.
In tali circostanze, quindi, una possibile selezione glucidica potrebbe ricadere su fonti composite di fruttosio e glucosio, ad alto indice glicemico ed a PRAL fortemente negativo (come ad esempio i datteri.
Queste sono le motivazioni biochimiche che devono essere tenute in considerazione, insieme ad altri importanti parametri chimico-metabolico-ormonali per la valutazione del potenziale lipogenico dei cibi, soprattutto in fasi sensibili della preparazione come quelle vicine all’evento agonistico.
In virtù di quanto asserito finora e sostenuto scientificamente, il soli indice glicemico e risposta insulinemica non rappresentano gli unici fattori responsabili delle potenzialità lipogeniche dei cibi glucidici.
Se così fosse, non si spiegherebbe perché il basso indice glicemico del fruttosio determini eventi lipogenici superiori a cibi più in alto nella scala.
E da qui balzano evidenti anche gli scopi di lucro sulla commercializzazione del fruttosio, quale “zucchero che non fa male” poiché di derivazione dalla frutta e quindi naturale.
Eh già… tale asserzione è infatti fonte di vizio intrinseco al significato stesso. Non si tratta di zucchero “della frutta” ma di zucchero “contenuto nella frutta”. Qui la dicitura è discriminatrice di grandi differenze: dire zucchero “della frutta” è come dire che si tratta della sola tipologia di zucchero contenuto in essa; dire, invece, zucchero “contenuto nella frutta” non esclude la presenza anche di altre fonti glucidiche chimicamente diverse, che nella fattispecie sono rappresentate dal glucosio.
Infatti, nessun frutto presenta un contenuto glucidico caratterizzato da fruttosio per il 100%. Pertanto, è più corretto dire che è l’apporto glucidico derivante dal consumo di frutta a non far male – ma non il fruttosio in quanto tale!
GLUCOCINASI
Non si può disquisire delle vie metaboliche del fruttosio senza far luce su un enzima chiave che agisce da selettore sui suoi correlati destini metabolici: la glucocinasi.
La glucocinasi è un enzima specifico per il glucosio. Catalizza la sua fosforilazione a glucosio-6-fosfato.
Nonostante sia un enzima che agisce sul glucosio come la esocinasi, rispetto a quest’ultimo si differenzia per alcuni aspetti cruciali che sono fondamentali a capire il nesso enzimatico che lega lipogenesi e assunzione di fruttosio.
Al di là delle differenti specificità catalitiche di substrato (l’esocinasi fosforila gli esosi in genere laddove, invece, la glucocinasi fosforila solo il glucosio) e di quelle legate alla specificità anatomo-tissutale (la glucocinasi non è presente nei muscoli), un ulteriore e rilevante discriminante della loro attività catalitica riguarda la loro differente capacità di attivarsi in funzione dei livelli ematici del glucosio. L’esocinasi presenta un Km=0,1mM. I bassi valori di questo parametro sono indice di attivazione enzimatica per bassi livelli di glucosio circolante (quindi è alta la sua affinità verso il glucosio). Invece, la glucocinasi presenta un Km=100mM, e cioè necessita di più elevate quantità di glucoso per attivarsi1. Tutto ciò risulta in linea con il basso livello d’affinità per il glucosio da parte delle proteine trasportatrici di glucosio “GLUT 2” a ridosso della membrana plasmatica del fegato (Km=15-20 mM), – ovvero è necessaria un’elevata quantità di glucosio per poter attivare i GLUT 2 epatici per l’ingresso del glucosio nell’epatocita ed essere metabolizzati – e l’elevato livello d’affinità (Km=5mM) posseduto dai trasportatori “GLUT 4” a ridosso della membrana plasmatica del miocita ed adipocita (sia relativamente al grasso bruno quanto a quello bianco).
In condizioni di non attivazione, la glucocinasi è sequestrata all’interno del nucleo e legata con la GKBP (proteina legante la glucocinasi) che non la rende biodisponibile.
Quando i livelli di glucosio salgono al di sopra della soglia stimolo per la glucocinasi, questa si stacca dalla GKBP e migra nell’ambiente citoplasmatico nella sua forma attiva, per fosforilare il glucoso e farlo entrare nel processo glicolitico.
Interessante è notare che la disponibilità di fruttosio, anche minima, rende attiva la glucocinasi per livelli di glucosio circolanti inferiori a quelli normalmente richiesti per la sua attivazione.
Questo è spiegato dall’azione di dismissione-inibitoria esercitata dal fruttosio-1-fosfato sull’attività regolatrice della GKBP. Pertanto, l’attività inibitrice di tale proteina sull’attività della glucocinasi viene meno anche in assenza di quantità sufficienti di glucosio circolante (necessarie a stimolare la glucocinasi) quando stimolata dalla presenza di fruttosio, anche in tracce6.
Inoltre, la glucocinasi è senza controllo allosterico in quanto non inibita dal suo stesso prodotto: glucoso-6-fosfato1. Pertanto, il processo glicolitico inizializzato dalla glucocinasi non conosce feedback negativo e continua finché è disponibile fruttosio. Maggiore è la disponibilità di fruttosio, tanto più spiccato sarà il metabolismo glicolitico e la disponibilità del tioestere finale “Acetil CoA”, che in presenza delle condizioni metaboliche e nutrizionali considerate (dieta iper/normoglucidica e riserve sature di glicogeno epatico) volgerà verso la lipogenesi.
Del dott. Francesco Casillo
NOTE BIBLIOGRAFICHE
1) Albert L. Lehninger. Biochimica – seconda edizione. Zanichelli.
2) Giuseppe Arienti. Le basi molecolari della nutrizione. Piccin.
3) AA.VV. – “Medico e metabolismo” anno 5 n. 2 – 2001.
4) Sito internet: unimi.it – “Shunt dei pentosi”, Biochimica San Paolo.
5) Am J Physiol. 1993 Jun;264(6 Pt 1):E855-62. Exercise increases muscle GLUT-4 levels and insulin action in subjects with impaired glucose tolerance. Hughes VA, Fiatarone MA, Fielding RA, Kahn BB, Ferrara CM, Shepherd P, Fisher EC, Wolfe RR, Elahi D, Evans WJ.
6) “Regulation of Hepatic Glucose Metabolism by Translocation of Glucokinase between the Nucleus and the Cytoplasm in Hepatocytes”, Y. Toyoda et. al., Horm Metab Res 33, 329-336 (2001).