GLICEMIK, carico glicemico e salute
 Il carico glicemico è un parametro indicante l’impatto che un cibo in determinate quantità ha sulla glicemia (livello di zuccheri nel sangue).
Il carico glicemico è un parametro indicante l’impatto che un cibo in determinate quantità ha sulla glicemia (livello di zuccheri nel sangue).
Conoscerlo e, quindi, saperlo calcolare è utile per diverse motivazioni annoverabili, in essenza, tra quelle del benessere e del bellessere.
Ciò è dovuto alle implicazioni ed influenze che l’assunzione di carboidrati (o zuccheri) – e conseguente rilascio di insulina – genera sulla composizione corporea (massa magra e massa grassa) e sul metabolismo dell’individuo.
Sulla rete (internet) vi sono diverse fonti che consentono di calcolarlo laddove, invece, la comodità a portata di mano per chi avesse uno smart phone risiede in applicazioni all’uopo indirizzate. Una di queste è “GLICEMIK” che consente di calcolare il carico glicemico per le oltre 350 voci alimentari presenti all’interno del suo database ed anche di eseguire il calcolo inverso, cioè calcolare QUALE quantità alimentare corrisponde ad un dato e noto carico glicemico che verrà inserito.
Esempi pratici dei due tipi calcoli eseguibili con Glicemik
“Vorrei sapere il valore di carico glicemico indotto da 250g di pizza o 250g di banana o 100g di datteri o altri alimenti per prendere coscienza sulla propensione che tali valori hanno nell’impattare la glicemia e/o favorire fenomeni di accumulo di grasso corporeo”.
OPPURE
“Vorrei sapere quanti grammi di banana o di mele o pizza o altri alimenti corrispondono ad un basso valore di carico glicemico, ad esempio 10, in modo da non stimolare i processi di accumulo di grasso corporeo.
Glicemik è disponibile per android
https://play.google.com/store/apps/details?id=com.kimecilg.glicemik&hl=it
e per Iphone
https://itunes.apple.com/it/app/id585812045?mt=8
pagina facebook
https://www.facebook.com/Glicemik
Cenni su alcuni effetti metabolici ed ormonali derivanti dall’assunzione dei carboidrati
L’assunzione di carboidrati (o zuccheri) genera un innalzamento della glicemia (livello di glucosio nel sangue). La risposta metabolico-ormonale nutriente-specifica approntata dall’organismo risulta la secrezione dell’ormone insulina.
L’insulina per il sistema nervoso centrale rappresenta il segnale di avvenuta introduzione nonché abbondanza energetica e a tale stimolo ormonale ne conseguono diversi effetti metabolici e di substrato di cui tra i più importanti si elencano:
- Enfatizzazione dell’utilizzazione glucidica
- Inibizione della lipolisi (cioè: inibizione dell’utilizzazione dei grassi di deposito a scopo energetico)
- Glicogenosintesi (deposito degli zuccheri in catene polimeriche sotto forma di glicogeno nel tessuto muscolare e nel fegato).
- Lipogenesi: conversione degli zuccheri in acidi grassi, loro esterificazione in trigliceridi e deposito nel tessuto adiposo.
E’ conseguenza, quindi, che elevati impatti glicemici (cioè alti livelli di carico glicemico) tanto più accentuano gli effetti indotti dall’insulina tra cui anche l’aumento del deposito dei trigliceridi (grassi) nel tessuto adiposo (grasso corporeo).
Questo evento oltre ad avere ripercussioni sugli obiettivi di carattere prettamente fisico-estetico (cioè sull’essere “in forma”) ha, inoltre e soprattutto, importanti ripercussioni sulla salute dell’individuo.
Carico glicemico e condizione fisico-estetica (effetti sulla forma fisica)
Pertanto, se attraverso la conduzione disciplinata di un programma d’allenamento si mira a favorire un miglioramento della composizione corporea prevalentemente da riduzione relativa (%) ed assoluta (kg) di MASSA GRASSA, una NON gestione ottimale nell’assunzione dei carboidrati (nelle sue componenti qualitativa e quantitativa insieme) potrebbe non solo non volgere all’ottimizzazione del risultato ricercato ma addirittura comprometterne gli esiti e cioè NON essere confacente agli obiettivi di DIMAGRIMENTO!
Tessuto adiposo e salute
Ma la necessità di favorire un decremento dei livelli di massa grassa non deve essere solo motivo di interesse verso il miglioramento dell’area fisico-estetica ma anche e soprattutto per preservare al meglio il proprio stato di salute dalle insidie fisiopatologiche che fanno seguito ad eccessi di accumuli adiposi.
Per capire meglio quali implicazioni ed effetti nefasti può generare l’incremento del tessuto adiposo sulla salute è necessario passare per una breve premessa sulla diversa anatomia dei diversi tipi di tessuto adiposo ed i loro effetti.
Cenni sull’anatomia del tessuto adiposo
Il grasso dell’area addominale si suddivide in 2 macro classi: grasso addominale sottocutaneo e grasso addominale intraaddominale.
Il grasso intraaddominale si sottoclassifica in:
Grasso viscerale o intraperitoneale (principalmente composto da grasso omentale e mesenterico) e
grasso retroperitoneale3.
Il grasso retroperitoneale rappresenta una piccola parte del grasso intraaddominale3.
Ancora, si è visto che il grasso viscerale rispetto a quello retroperitoneale ha una più elevata correlazione con le variabili metaboliche sistemiche, tra le quali: livelli plasmatici di insulina, livello di zuccheri nel sangue e pressione sistolica3.
L’Accumulo di grasso corporeo, soprattutto quello viscerale nell’area addominale è responsabile di un circolo vizioso di alterazioni metaboliche di substrato ed ormonali favorenti diabete e future complicazioni cardiovascolari rispetto all’obesità periferica e gluteo-femorale1.
Il grasso viscerale rappresenta un importante link/connessione tra le diverse “facce” della sindrome metabolica: intolleranza al glucosio, ipertensione, dislipidemia e resistenza all’insulina6.
Tuttavia è emerso che anche il grasso sottocutaneo QUANDO localizzato nella zona del tronco (torace ed addome) contribuisce ad innescare fenomeni di insulino-resistenza rispetto al grasso sottocutaneo presente in altre regioni del corpo4; e, quindi, anche il grasso sottocutaneo – e non solo quello viscerale – quale componente dell’obesità centrale presenta una forte associazione con l’insulino-resistenza5.
L’obesità addominale (grasso addominale-intraaddominale-viscerale e grasso addominale sottocutaneo) è stata correlata alle alterazioni dei livelli delle lipoproteine plasmatiche ed in modo particolare all’incremento dei livelli plasmatici dei trigliceridi e bassi livelli di HDL2 (quest’ultimo più comunemente noto come: colesterolo buono).
Il grasso addominale-intraaddominale-viscerale presenta il più elevato tasso/risposta lipolitico/a rispetto agli altri depositi di grasso1.
Per via della sua anatomia è in grado di avere effetti sul metabolismo del fegato.
Infatti, gli adipociti viscerali addominali sono più sensibili all’azione delle catecolamine rispetto a quelli che costituiscono il grasso sottocutaneo addominale2.
L’incrementata sensibilità ai processi lipolitici dovuti alle catecolamine in seno al grasso omentale in soggetti non obesi è associato ad un incremento del numero dei recettori adrenergici beta 1 e beta 22.
Tutto ciò è associato ad un’incrementata sensibilità dei recettori adrenergici beta 32.
Nei soggetti obesi vi è un’incrementata risposta lipolitica alle catecolamine a livello addominale piuttosto che nella zona gluteo-femorale e l’aspetto degno di rilevanza è che all’aumentata lipolisi del grasso viscerale si accompagna una ridotta sensibilità all’effetto antilipolitico indotto dall’insulina2.
Ciò significa che tale quadro può portare ad un incrementato flusso di acidi grassi liberi nel sistema venoso portale con diversi possibili effetti sul metabolismo del fegato. Questi includono: produzione di glucosio, secrezione di VLDL, interferenza con la clearance epatica di insulina portando conseguentemente ad una condizione di dislipoproteinemia, intolleranza al glucosio ed iperinsulinemia2.
Inoltre, l’anomala elevata deposizione di grasso viscerale è conosciuta con il nome di obesità viscerale. Tale fenotipo di composizione corporea è associata alla sindrome metabolica, patologie cardiovascolari e diverse neoplasie tra cui cancro al seno, alla prostata e colon rettale17.
Ed è il grasso viscerale che contribuisce significativamente sul livello di acidi grassi liberi nel flusso sanguigno rispetto al grasso sottocutaneo1.
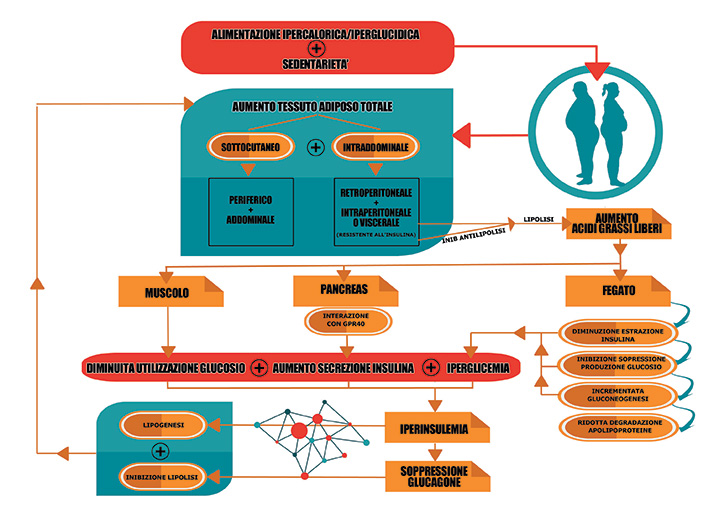
Ora vediamo, come riassunto schematicamente nel grafico, cosa accade quando si è in presenza di elevati livelli di grasso viscerale dovuti ad uno scorretto stile di vita: iperalimentazione in sinergia alla sedentarietà.
1) Fenomeni di lipolisi sul grasso viscerale e conseguente aumento del livello di acidi grassi nel sangue.
2) Gli acidi grassi liberati nel flusso sanguigno generano ripercussioni metabolico ormonali su diversi livelli: sull’area muscolare, sul fegato e sul pancreas.
2a) A livello della muscolatura scheletrica: vi è un decremento dei trasportatori di glucosio (GLUT-4)8.
Quindi meno glucosio entra nelle cellule muscolari!
Inoltre, si registra anche l’inibizione dell’enzima esocinasi e quindi la non capacità di fare entrare il glucosio all’interno della glicolisi9; ciò significa scarsa capacità di utilizzo del glucosio e ridotti tassi di risintesi del glicogeno muscolare10(riserva energetica glucidica di pronto utilizzo).
Altresì viene inibito l’incremento degli IRS-1 (recettori all’insulina)1.
Le alterazioni a livello muscolare portano ad una maggiore presenza di glucosio nel sangue!
2b) A livello del pancreas.
Per quanto il glucosio rappresenti lo stimolo nutrizionale elettivo per la secrezione dell’insulina, gli acidi grassi a lunga catena interagiscono con un proteina recettoriale altamente espressa nel fegato: la GPR40. L’interazione “acido grasso-GPR40” amplifica la stimolazione del glucosio sulla secrezione dell’insulina aumentandone, pertanto, i livelli nel sangue7 (iperinsulinemia)!
2c) A livello del fegato:
Un elevato flusso di acidi grassi nel fegato induce un decremento dell’estrazione di insulina da parte dello stesso fegato per via dell’inibizione del suo legame recettoriale sul fegato nonché della sua degradazione portando ineluttabilmente ad una condizione di iperinsulinemia nonché al venir meno della soppressione della produzione epatica di glucosio2.
In più, gli acidi grassi accelerano anche i processi di gluconeogenesi2 ( cioè la produzione di glucosio a partire da altri substrati: esempio aminoacidi) esaltando ancor di più gli stadi iperglicemici!
A rendere il quadro ancora più nefasto è che in risposta all’ampia disponibilità di acidi grassi l’incrementata esterificazione degli acidi grassi e ridotta degradazione epatica delle “apolipoproteine B” porta alla sintesi e secrezione delle aterogeniche VLDL2.
La sommatoria degli effetti esercitati dagli acidi grassi sui diversi tessuti porta a condizioni di IPERGLICEMIA e, quindi, ad un quadro metabolico-ormonale alterato che predispone alla sindrome metabolica!
Inoltre, gli eventi evocati dagli acidi grassi derivanti dal processo lipolitico sul grasso viscerale portano ad innescare ed alimentare un circolo vizioso che in modo esemplificativo – ma non esaustivo – può essere visto in duplice chiave:
- Gli stati iperglicemici ed iperinsulinemici instaurati favoriscono ulteriore deposito di grasso.
- Da un altro lato l’iperinsulinemia evocata è ANTITETICA alla secrezione dell’ormone glucagone (ormone iperglicemizzante ed anche lipolitico) ed in tal modo blocca anche la lipolisi, cioè la possibilità di poter usare i grassi di deposito a scopo energetico.
Ecco, dunque, che il sommarsi di lipogenesi (formazione dei grassi) e antilipolisi (inibizione del catabolismo dei grassi) favoriscono – nel soggetto che presenta elevati livelli di grasso viscerale – ulteriori incrementi quantitativi dello stesso perpetuando in tal modo le alterazioni metaboliche di substrato di cui è responsabile ed inficiando in tal modo sulla salute dell’individuo!
Infatti, per via dei motivi summenzionati, nei soggetti in sovrappeso risulta spiccata la “De novo lipogenesi” ancora prima del consumo di un pasto! E ciò è positivamente correlato ai livelli glicemici ed insulinemici presenti a digiuno13.
Tessuto adiposo e patologie
Infatti, il tessuto adiposo è secretore di numerose adipochine, pro e anti infiammatorie che hanno profonde ripercussioni sul metabolismo.
All’aumentare del tessuto adiposo aumenta la secrezione delle adipochine pro infiammatorie e diminuisce quella delle adipochine anti infiammatorie19.
L’obesità (soprattutto da grasso viscerale in quanto quest’ultimo produce più citochine rispetto a quello sottocutaneo) rappresenta uno stato/condizione di infiammazione cronica sistemica dato che il grasso viscerale è positivamente correlato alla Proteina C Reattiva (marker infiammatorio) 19,21
L’infiammazione cronica sistemica è riconosciuta per essere la causa di molteplici forme di cancro nonché di altri stati patologici: diabete di tipo 2, sindrome metabolica, aterosclerosi, demenza, problemi cardiovascolari18,20.
L’infiammazione determina alterazioni sulla sensibilità dei recettori all’insulina favorendo in tal modo la resistenza all’insulina.
L’insulino resistenza promuove lo sviluppo di tumori attraverso diversi meccanismi. Le cellule neoplastiche utilizzano il glucosio per proliferare, perciò l’iperglicemia favorisce la carcinogenesi per l’instaurazione di un ambiente favorevole alla crescita tumorale18.
Vi è un’associazione positiva tra elevati livelli circolanti di insulina e glucosio ed un incrementato rischio per cancro colon-rettale ed al pancreas18.
I recettori per l’insulina ed i trasportatori di glucosio sensibili all’insulina visti a livello della regione temporale media del cervello che presiede alla formazione della memoria, suggeriscono l’importanza dell’insulina ai fini del mantenimento della fisiologica ed appropriata funzione cognitiva.
E’ stata discussa la relazione diretta tra la compromessa segnalazione di insulina ed IGF e l’incrementato deposito del peptide AB nelle placche amiloidi responsabile della neurodegenerazione.
Gli scarsi livelli d’insulina o l’insulino resistenza a livello cerebrale sarebbe responsabili della morte neuronale dovuta dal venir meno della presenza dei fattori tropici da deficit nel metabolismo energetico, favorendo così anche la potegenesi di una delle più comuni forme di demenza: La malattia di Alzheimer21.
E come detto l’insulino-resistenza è mediata da processi infiammatori che avvengono in seno alla crescita del tessuto adiposo.
Una delle possibili soluzioni atte ad indurre un miglioramento dello stato di salute consiste nel favorire un decremento dei depositi di tessuto adiposo, soprattutto quello dell’area addominale.
Questo può essere fatto attraverso l’azione combinata di un equilibrato stile alimentare su base quotidiana e la conduzione di un regime di esercizio fisico regolare adeguato alle proprie disponibilità psico-emotivo-fisico-motorie e nel migliorare il proprio stile di vita modulandone gli stressors!
Sebbene un’introduzione alimentare che risulti superiore rispetto ai propri reali fabbisogni metabolici ed energetici non sia mai una scelta da prendere in considerazione, tuttavia è difficile quanto rara che l’accezione di “Iper” sia di derivazione prevalentemente proteica e/o lipidica senza coinvolgere la sfera glucidica.
Ciò per via di aspetti prettamente culturali e di esigenza pratica.
“Culturali”: poiché è nella cultura dell’italiano pasteggiare nei pasti principali (colazione, pranzo e cena) con cereali, farinacei e loro derivati (pane, pasta, pizza, grassini, crackers, etc.) e non, quindi, SOLAMENTE con alimenti ESCLISIVAMENTE PROTEICI e LIPIDICI (solo carne e/o solo pesce ad esempio).
Di “esigenza pratica” poiché nelle pause di lavoro o di studio o comunque nelle finestre temporali che intermezzano i pasti principali (cioè: metà mattino e metà sera) non si suole pasteggiare con alimenti totalmente proteici (carni, uova, pesce) ma con cibi prettamente o parzialmente glucidici: panini, sandwich, yogurt con frutta, frutta, crackers, pasti da fast foods, etc).
Di fatti i soggetti in sovrappeso, obesi e riportanti patologie correlate a tali status ponderali non sono coloro che riportano nel loro stile alimentare iperintroduzione proteica e lipidica CON CONTEMPORANEA bassa o assente introduzione glucidica (carboidrati) in seno all’alveo dei singoli pasti giornalieri di loro consumo; è invece vero l’opposto e cioè che il loro status ponderale (qualora non derivi da malattie genetiche e/o disfunzioni ormonali non compensate) – da un punto di vista delle abitudini alimentari – è dato da un prevalente contenuto glucidico-dietetico in termini % e/o assoluti.
Premesso che le fonti alimentari glucidiche sono parte importante di un regime nutrizionale bilanciato (e questo è soprattutto vero per quelle che rispetto ad altre presentano un spettro chimico-fisico di importante valore nutrizionale sotto diversi punti di vista: tipo di glucidi, contenuto di fibra, contenuto vitaminico-minerale, contenuto idrico, e capacità alcalinizzanti, etc.) non si tratta di escluderle ma piuttosto di saperle gestire qualitativamente e quantitativamente per l’optimum della propria resa psico-fisica e per mantenere integro se non per potenziare il proprio stato di salute.
Infatti, fonti alimentari ad alto tenore glucidico tipiche dei regimi nutrizionali occidentali generano un elevata risposta glicemica favorente l’ossidazione postprandiale dei carboidrati deprimendo in tal modo quella dei grassi, e perciò risultano inclini a favorire l’accumulo di grasso12.
Invece, approcci che generano una bassa risposta glicemica possono migliorare il controllo del peso corporeo poiché favoriscono il senso di sazietà, minimizzano la secrezione di insulina postprandiale e supportano il preservamento della sensibilità all’insulina12.
Ciò è supportato dal fatto che molti studi hanno riportato valori di perdita di peso corporeo superiori quando i regimi nutrizionali all’interno di un contesto ipocalorico prevedevano fonti alimentari a basso indice glicemico rispetto a quelle ad alto indice glicemico12.
Sebbene il controllo glicemico rivesta un ruolo cruciale nel modulare la risposta insulinica, questo aspetto assume una rilevanza maggiore soprattutto nei soggetti in sovrappeso.
Infatti è risultato che in seguito ad un pasto iperglucidico soggetti in sovrappeso abbiano riportato iperinsulinemia nonché concentrazioni di acidi grassi e trigliceridi superiori rispetto ai soggetti magri13.
La non appropriata modulazione del carico glicemico è anche responsabile di inficiare sui livelli si massa magra.
Infatti, è stato osservato che ALTI carichi glicemici determinano un bilancio azotato negativo per via della stimolazione di ormoni proteolitici12(cioè ormoni che agiscono sulla distruzione proteica).
Inoltre, aberranti valori di carico glicemico oltre a scatenare le alterazioni metaboliche descritte sono anche condizionanti i comportamenti alimentari successivi in termini di selezionamento della qualità e quantità delle fonti alimentari dei pasti a seguire. Ciò è dovuto a diversi fattori di natura metabolica ed ormonale.
Infatti, ALTI carichi glicemici determinano un maggior declino dei livelli di leptina ed anche un rapido decremento dei livelli glicemici con la conseguenza di una minor stimolazione temporale dei recettori gastrointestinali per CCK, GLP-1 e GIP e, quindi, anche in una loro minor stimolazione temporale diretta e/o indiretta dei centri della sazietà del cervello12,14,.
Oltre a ciò alti livelli di carico glicemico sono stati positivamente associati al rischio di cancro colon-rettale16.
Per svariate ragioni, tra cui anche per quelle fin’ora esposte, è assolutamente auspicabile condurre uno stile di vita sano che metta in risalto l’attenzione verso uno stile nutrizionale equilibrato e bilanciato in seno alla frequenza dei pasti giornalieri, alla scelta qualitativa e quantitativa degli alimenti che compongono i singoli pasti ed al rapporto ottimale tra i nutrienti in seno ai singoli pasti, nonché verso la costante pratica di attività fisica (meglio se guidata da un valido allenatore o personal trainer) che deve promuovere l’ottimizzazione dei sistemi metabolico-ormonali per favorire la salute del singolo.
E GLICEMIK è il valido calcolatore che consente di prendere coscienza sull’impatto glicemico e le sue conseguenze (tra cui anche la stimolazione dei processi che favoriscono l’aumento della massa grassa) indotto dal connubio delle accezioni qualitative e quantitative dello stile nutrizionale.
Bibliografia
- Obes Rev.2010 Jan;11(1):11-8. doi: 10.1111/j.1467-789X.2009.00623.x. Epub 2009 Jul 28. Subcutaneous and visceral adipose tissue: structural and functional differences.Ibrahim MM.Cardiology Department, Cairo University, 1 El-Sherifein Street, Abdeen, Cairo 11111, Egypt.
- Bernardo Léo Wajchenberg Subcutaneous and Visceral Adipose Tissue: Their Relation to the Metabolic Syndrome Endocrine Reviews December 1, 2000 vol. 21 no. 6 697-738
- Märin P, Andersson B, Ottosson M, Olbe L, Chowdhury B, Kvist H, Holm G, Sjöström L, Björntorp P1992 The morphology and metabolism of intraabdominal adipose tissue in men. Metabolism41:1242–1248
- Abate N, Garg A, Peshock RM, Stray-Gundersen J, Grundy SM1995 Relationships of generalized and regional adiposity to insulin sensitivity in men. J Clin Invest96:88–98
- Goodpaster BH, Thaete FL, Simoneau J-A, Kelley DE1997 Subcutaneous abdominal fat and thigh muscle composition predict insulin sensitivity independently of visceral fat. Diabetes46:1579–1585.
- Desprès J-P1996 Visceral obesity and dyslipidemia:contribution of insulin resistance and genetic susceptibility. In: Angel A, Anderson H, Bouchard C, Lau D, Leiter L, Mendelson R (eds) Progress in Obesity Research: Proceedings of the Seventh International Congress on Obesity (Toronto, Canada, August 20–25, 1994). John Libbey & Company, London, vol7:525–532
- Nature. 2003 Mar 13;422(6928):173-6. Epub 2003 Feb 23. Free fatty acids regulate insulin secretion from pancreatic beta cells through GPR40.Itoh Y, Kawamata Y, Harada M, Kobayashi M, Fujii R, Fukusumi S, Ogi K, Hosoya M, Tanaka Y, Uejima H, Tanaka H, Maruyama M, Satoh R, Okubo S, Kizawa H, Komatsu H, Matsumura F, Noguchi Y, Shinohara T, Hinuma S, Fujisawa Y, Fujino M.
- Vettor R, Fabris R, Serra R, Lombardi AM, Tonello C, Granzotto M, Marzolo MO, Carruba MO, Ricquier D, Federspil G, and Nisoli E. Changes in FAT/CD36, UCP2, UCP3 and GLUT4 gene expression during lipid infusion in rat skeletal and heart muscle. Int J Obes Relat Metab Disord26: 838–847, 2002.
- Thompson AL and Cooney GJ. Acyl-CoA inhibition of hexokinase in rat and human skeletal muscle is a potential mechanism of lipid-induced insulin resistance. Diabetes49: 1761–1765, 2000
- How Free Fatty Acids Inhibit Glucose Utilization in Human Skeletal Muscle. Michael Roden. Physiology June 1, 2004 vol. 19 no. 3 92-96
- Dresner A, Laurent D, Marcucci M, Griffin ME, Dufour S, Cline GW, Slezak LA, Andersen DK, Hundal RS, Rothman DL, Petersen KF, and Shulman GI. Effects of free fatty acids on glucose transport and IRS-1-associated phosphatidylinositol 3-kinase activity. J Clin Invest103: 253–259, 1999
- Glycemic index and obesity.Janette C Brand-Miller, Susanna HA Holt, Dorota B Pawlak, and Joanna McMillan
- Postprandial de novo lipogenesis and metabolic changes induced by a high-carbohydrate, low-fat meal in lean and overweight men. Iva Marques-Lopes, Diana Ansorena, Iciar Astiasaran, Luis Forga, and J Alfredo Martínez. Am J Clin Nutr February 2001 vol. 73 no. 2 253-261
- Interaction of insulin, glucagon-like peptide 1, gastric inhibitory polypeptide, and appetite in response to intraduodenal carbohydrate. J H Lavin, G A Wittert, J Andrews, B Yeap, J MWishart, H A Morris, J E Morley, M Horowitz, and N W Read..Am J Clin Nutr September 1998 vol. 68 no. 3 591-598
- Depot-specific hormonal characteristics of subcutaneous and visceral adipose tissue and their relation to the metabolic syndrome.Wajchenberg BL, Giannella-Neto D, da Silva ME, Santos RF. Horm Metab Res. 2002 Nov-Dec;34(11-12):616-21.
- Dietary glycemic load and colorectal cancer risk. S. Franceschi, L. Dal Masco, L. Augustin,E. Negri4, M. Parpinel, P. Boyle, D. J. A. Jenkins and C. La Vecchia. Ann Oncol (2001) 12 (2): 173-178.
- Br J Radiol. 2012 Jan;85(1009):1-10. The clinical importance of visceral adiposity: a critical review of methods for visceral adipose tissue analysis. Shuster A, Patlas M, Pinthus JH, Mourtzakis M.
- Sedentary Behavior and Cancer: A Systematic Review of the Literature and Proposed Biological Mechanisms. Brigid M. Lynch. Cancer Epidemiol Biomarkers Prev November 2010 19; 2691
- Adipokines in inflammation and metabolic desease. Reviews. Focus on metabolism and immunology.
- MUSCLE AGING AND INFLAMMATION. Ana Maria Teixeira, Centro de Estudos Biocinéticos, Faculdade de Ciências do Desporto e Educação Física. Universidade de Coimbra
- Review ArticleAlzheimer’s Disease Promotion by Obesity: Induced Mechanisms—Molecular Links and Perspectives.Rita Businaro,Flora Ippoliti,Serafino Ricci,Nicoletta Canitano,Andrea Fuso.Current Gerontology and Geriatrics Research. Volume 2012 (2012), Article ID 986823, 13 pages