Proteine e Grasso corporeo o meglio Proteine e Lipogenesi (sintesi degli acidi grassi) risultano in un accoppiamento che per noi bodybuilder e amanti del fitness è avvertito come un’associazione dal risultato cacofonico.
Quante volte abbia sentito dire dal nostro medico di famiglia, dal dietologo, nelle trasmissioni televisive a carattere medico che per stare in forma e decrementare la massa adiposa necessitiamo di sbilanciare in negativo l’equilibrio energetico giornaliero, tramite aumento della spesa energetica quotidiana e/o un introito calorico inferiore alla spesa stessa?
Quante volte abbiamo sentito proferire da figure professionali (nutrizionisti) – che godono di un’ampia influenza demoscopica – che tutti gli eccessi calorici vengono trasformati in trigliceridi ed immagazzinati nel tessuto adiposo?
E quante altre volte abbiamo sentito (e non digerito) che anche le proteine (se in eccesso) possono dar luogo a biosintesi lipidica (e, quindi, anche ad un aumento del grasso corporeo) alla stessa stregua di glicidi e lipidi assunti in eccesso su base isocalorica (cioè, per un pari quantitativo calorico)?
Sulla base di tali asserzioni sentite, fagocitate e digerite, proteine e grasso corporeo sembra rappresentare un connubio indissolubile.
Ma allora come si spiega l’eccellente definizione muscolare e gli addominali cesellati di bodybuilder agonisti e no, accomunati, – seppur con qualche differenza interdietetica – da una netta prevalenza calorica protidica e da un basso regime glucidico nel loro programma alimentare quotidiano per favorire il processo chiamato di “definizione muscolare”?
Ancora, come si spiega l’alta qualità muscolare indotta da una dieta iperproteica, indipendentemente dall’apporto calorico ad essa connesso?
E’ ovvio che i conti non tornano e, quindi, l’accostamento proteine e grasso corporeo assume dei toni flebili a riguardo, proprio perché l’evidenza dei fatti non sostiene la teoria del semplice conteggio matematico calorico quale elemento deterministico della composizione corporea.
Questo perché, fondamentalmente, il nostro organismo è molto più sensibile a una “matematica ormonale e biochimica” piuttosto che alla mera matematica algebrica.
Si vuole asserire, ed è anche evidente, che il singolo individuo non può essere considerato alla stessa stregua di una bomba calorimetrica (per la quale un grammo di proteine ed un grammo di carboidrati non sono differenti da un punto di vista calorico, dato che generano – circa – la stessa resa calorica: 4kcal), in quanto questa esula da qualsiasi considerazione di natura squisitamente endocrina e biochimica.
D’altro canto hanno visto bene Barry Sears con la sua “Enter the Zone”, il dottor Mauro Di Pasquale con la sua “The Metabolic Diet” ed il dottor Atkins con la sua “Atkins Diet”: a parità di introito calorico, una dieta iperproteica è più lipolitica e meno lipogenetica della iperglucidica.
Esperti in materia come Will Brink e lo stesso Mauro Di Paquale affermano che la molecola proteica è il nutriente meno probabile ad essere convertito in acidi grassi e quindi depositato sotto tale forma in seno al tessuto adiposo.
Dunque perché così tanta discrepanza, anche nell’ambito della comunità medica? Per poter dare luce alla fondatezza che risiede dietro tali affermazioni – nettamente contrastanti tra loro – ecco che la biochimica è la materia alla quale bisogna fare ricorso.
Dall’analisi biochimica degli eventi biosintetici degli acidi grassi, vedremo come opinioni discordanti abbiano in comune le medesime tappe biochimiche, seppur interpretate differentemente.
Biochimica della biosintesi degli acidi grassi
La biosintesi degli acidi grassi avviene a partire dal suo precursore immediato, l’Acetil CoA, nel citosol delle cellule epatiche, del tessuto adiposo e nella ghiandola mammaria degli animali superiori.
L’Acetil CoA, molecola “primer” della sintesi degli acidi grassi, deriva dal catabolismo del glucosio, degli acidi grassi e degli aminoacidi (figura n.1).
FIGURA 1
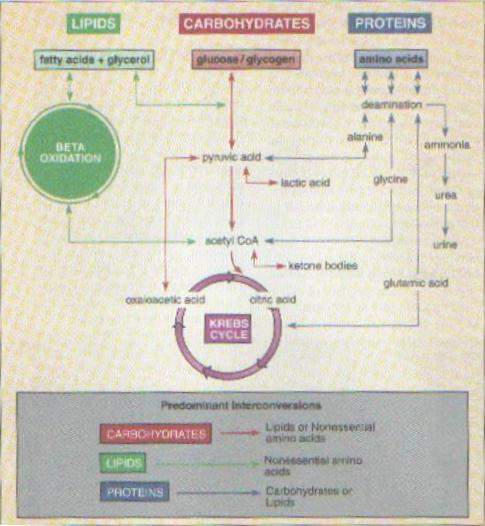
Questa può andare incontro a differenti destini, a seconda delle condizioni di carica energetica cellulare.
In condizioni di bassa carica energetica cellulare, viene ossidata all’interno del Ciclo di Krebs per estrarre energia tramite la produzione di GTP e la riduzione di NAD+ e FAD+ in NADH e FADH, che cederanno i loro elettroni alla catena di trasporto degli elettroni per promuovere i processi della fosforilazione ossidativa (figura n.2).
Quando, invece, la carica energetica cellulare è abbondante, i processi di estrazione dell’energia vengono sostituiti dai processi di biosintesi, che implicano quindi (nel caso di biosintesi degli acidi grassi) la non ossidazione dell’Acetil CoA ma il suo utilizzo quale substrato “primer” per la successiva elongazione dell’acido grasso.
Inoltre la presenza di citrato è necessaria affinché la biosintesi dell’acido grasso abbia luogo.
La biosintesi si muove verso la formazione dell’Acido Palmitico a 16 atomi di carbonio. La sintesi degli acidi grassi è catalizzata da una serie di enzimi proteici chiamati “complesso dell’acido grasso sintetasi”.
Delle otto unità bicarboniose di Acetil CoA necessarie per la sintesi dell’acido Palmitico a 16 atomi di carbonio, soltanto una è fornita dall’Acetil CoA in quanto tale, perché le altre 7 arrivano sotto forma di Malonil CoA.
Il potere riducente per la biosintesi è fornito dal NADPH.
Prima di scendere nel dettaglio dell’analisi biochimica dei fenomeni alla base della sintesi degli acidi grassi, è bene tenere quindi a mente che affinché il processo biosintetico possa avvenire è necessaria la presenza di Acetil CoA , Citrato e NADPH.
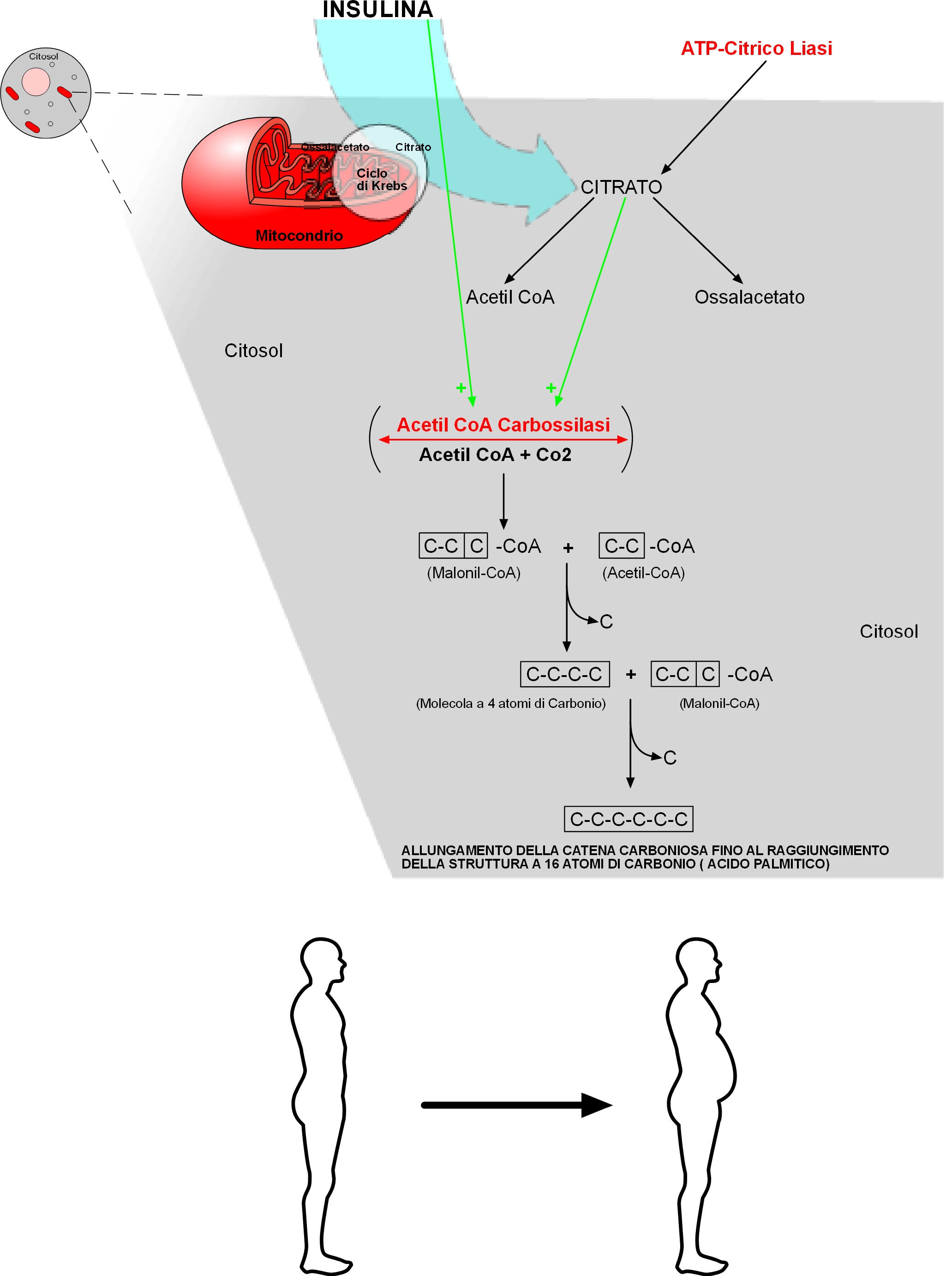
Come già detto, i processi biosintetici degli acidi grassi avvengono nel citosol e quindi implicano che l’Acetil CoA esca dal Ciclo di Krebs che avviene all’interno del mitocondrio.
L’Acetil CoA non è in grado di passare dai mitocondri al citosol (luogo di biosintesi).
Ecco che, invece, il Citrato formatosi nel Ciclo di Krebs
(all’interno del mitocondrio) da Acetil CoA e ossalacetato può passare attraverso la membrana mitocondriale verso il citosol, grazie al sistema di trasporto degli acidi tricarbossilici.
Nel citosol, l’Acetil CoA si riforma grazie all’enzima “ATP-citrico liasi” che spezza il Citrato.
In precedenza si è detto che oltre il “Primer” (Acetil CoA), indispensabile per dare il via alla biosintesi, le altre 7 unità bicarboniose che completano la sintesi devono arrivare al “complesso dell’acido grasso sintetasi” sotto forma di Malonil CoA. Il Malonil CoA si forma dall’unione di una molecola di Acetil CoA e una molecola di Co2.
Questa reazione è catalizzata dall’enzima “Acetil CoA Carbossilasi” che contiene la Biotina, la quale a sua volta serve da trasportatore intermedio di una molecola di Co2.
L’Acetil CoA Carbossilasi è un enzima allosterico, la cui reazione catalizzata è la tappa principale che regola o limita la velocità di biosintesi degli acidi grassi. Questo enzima è inattivo in assenza dei suoi modulatori positivi: citrato e isocitrato – ecco quindi che la notevole stimolazione allosterica di questo enzima da parte del citrato spiega perché il citrato stesso sia richiesto per la sintesi degli acidi grassi (figura n.2).
FIGURA 2
La breve rassegna degli eventi biochimici fin qui trattati, mette alla luce quindi quali motivazioni stanno alla base della credenza comune che ha sempre indotto molti professionisti nel sostenere che tutti gli eccessi energetici, indipendentemente dalla ripartizione dei macronutrienti, determinano in eguale modo un accumulo degli eccessi stessi sotto forma di trigliceridi nel tessuto adiposo, poiché il catabolismo di aminoacidi, glucosio, acidi grassi volge verso una comune via: l’Acetil CoA.
Fondamentalmente questo discorso filerebbe senza fare una piega, con l’assenso unanime sul fatto che anche le proteine siano in grado di generare lipogenesi nella stessa misura delle altre macromolecole – se non si tenesse in considerazione la risposta endocrina “insulina-glucagone” indotta dall’assunzione del cibo e l’influenza che “l’output ormonale” indotto ha sul destino delle reazioni biochimiche che mettono capo agli eventi biosintetici.
Vi sono fondamentalmente 4 punti che condizionano gli eventi di lipogenesi dei quali normalmente non si tiene conto.
1)L’Acetil CoA formatosi dal catabolismo delle forme elementari dei macronutrienti entra nel Ciclo di Krebs reagendo con l’ossalacetato per formare Citrato. Come si è visto in precedenza, il Citrato (per poter innescare i processi di liposintesi) deve uscire dal Ciclo di Krebs (che avviene nei mitocondri) per spostarsi verso il citosol quale luogo di biosintesi.
La fuoriuscita del Citrato è indotta dall’Insulina.
Una volta nel Citosol, dal citrato si riforma Acetil CoA che agisce da “primer”.
Si è visto anche che l’allungamento della catena dell’acido palmitico è dato dalla formazione di Malonil CoA, prodotto dalla reazione tra Acetil CoA e Co2, catalizzata dall’enzima Acetil CoA Carbossilasi.
L’enzima (Acetil CoA Carbossilasi) non è stimolato solo dalla presenza del Citrato ma anche dall’Insulina stessa.
Quindi, in una dieta dall’assetto ipoglucidico, la risposta insulinica non è la stessa di una dieta normoglucidica (50-60% glucidi!) di pari calorie; e così pure la fuoriuscita del Citrato e l’attivazione dell’enzima Acetil CoA Carbossilasi risultano alterati dalla variazione della concentrazione insulinemica piuttosto che dall’introito calorico di per sé.
Questa considerazione, già vantaggiosa per la scarsa stimolazione insulinica, può essere resa maggiormente favorevole se i carboidrati introdotti derivano da fonti a basso indice glicemico.
L’assetto ipoglucidico ed il basso indice glicemico fanno conseguire un basso carico glicemico, elemento chiave nella stimolazione dell’increzione insulinemica.
Si ricorda che non è tanto l’indica glicemico del carboidrato introdotto il responsabile principale della secrezione insulinica, quanto lo è, invece, il carico glicemico (“Glicemic Load”) risultante dal prodotto del quantitativo di glucidi introdotti per volta ed il loro indice glicemico.
2) Ancora, quando la carica energetica cellulare è bassa o nei casi in cui la glicemia risulti bassa per un deficit momentaneo (per esempio, indotto dall’allenamento) o protratto (nel caso di dieta ipoglucidica) si attivano processi di gluconeogenesi.
Uno dei substrati utilizzati per produrre glucosio in assenza di una sua assunzione o somministrazione esogena è un intermedio del ciclo degli acidi tricarbossilici: l’Ossalacetato.
I processi di gluconeogenesi si realizzano nel fegato.
Quando l’ossalacetato è utilizzato come precursore del glucosio, viene sottratto al Ciclo di Krebs, impossibilitando l’Acetil CoA (derivato ultimo della degradazione dei nutrienti) ad entrare nello stesso ciclo ed a reagire con l’Ossalacetato per la successiva formazione di Citrato.
Il venir meno di questa reazione (Ossalacetato + Acetil CoA = Citrato) volge non solo verso la minor disponibilità nel citosol della molecola che dà inizio ai processi di biosintesi degli acidi grassi, l’Acetil CoA, la quale non potendo entrare nel Ciclo di Krebs va incontro alla formazione di corpi chetonici (che saranno in parte degradati a scopo energetico dal tessuto metabolicamente attivo e in parte espulsi tramite la respirazione e le urine), ma anche alla carenza del citrato nel citosol (che come precedentemente detto, se presente, agirebbe da modulatore positivo per la stimolazione allosterica dell’enzima che catalizza la formazione di Malonil CoA: l’Acetil CoA Carbossilasi).
3)Rapporto glucagone-insulina dopo pasto iperproteico. Dopo una pasto a base di glucidi aumenta la glicemia e viene liberata l’Insulina, cosicché viene inibita la produzione del Glucagone.
Dopo una pasto proteico, invece, aumenta l’aminoacidemia, che stimola anch’essa l’increzione insulinemica.
Tuttavia, la concentrazione plasmatica del glucosio non può essere mantenuta perché non vi è apporto di glucosio col pasto stesso; di conseguenza aumenta anche la liberazione di Glucagone nel plasma, cosicché la concentrazione plasmatica di glucosio viene sostenuta dalla glicogenolisi epatica e dalla gluconeogenesi.
Si ricorda che il Glucagone è un ormone polipeptidico che svolge la sua azione sul fegato – promuovendo glicogenolisi (epatica) – e sul tessuto adiposo – generando lipolisi giustificata anche dal fatto che il catabolismo dei trigliceridi porta alla liberazione di glicerolo, anch’esso substrato importante per i processi gluconeogenici.
Ecco che, quindi, la liberazione di Insulina (ormone ipoglicemizzante, glicogenosintetico, lipogenetico) e di Glucagone (ormone iperglicemizzante, glicogenolitico epatico e lipolitico) dipende dalla qualità degli alimenti ingeriti e non dal semplicistico conteggio calorico indipendentemente dalla natura della macromolecola assunta.
4)Degradazione ossidativa degli aminoacidi.
E’ noto che gli aminoacidi sono le unità elementari deputate alla costruzione proteica: essi sono, inoltre, precursori di altre importanti biomolecole come ormoni, purine, pirimidine, porfirine e alcune vitamine.
Tuttavia nel caso in cui il loro apporto con la dieta superi la quantità necessaria al normale turnover proteico, vengono utilizzati come fonte energetica.
Per essere utilizzati a scopo energetico, perdono i loro gruppi amminici e i loro scheletri di carbonio subiscono due processi principali: conversione in glucosio nel processo di gluconeogenesi od ossidazione a CO2 nel ciclo degli acidi tricarbossilici.
La rimozione del gruppo amminico è una tappa fondamentale nel catabolismo dell’aminoacido, e vi sono due vie enzimatiche che portano alla sua rimozione: la transaminazione e la deaminazione ossidativa.
Nella transaminazione il gruppo amminico è trasferito all’atomo di carbonio di una alfa chetoacido, che è nella maggior parte dei casi l’Acido alfa chetoglutarico, trasformando lo stesso tramite aminazione in Acido l-glutamico.
L’Acido glutamico formato per azione delle transaminasi può subire una rapida deaminazione ossidativa, catalizzata dalla Glutammico Deidrogenasi, eliminando così come NH4+ i gruppi amminici derivati dagli altri aminoacidi. Per questo processo è necessaria una deidrogenazione, e la Glutammico Deidrogenasi può utilizzare sia NAD+ che NADP+ come accettore di elettroni, ma preferisce il NAD+.
Il NADH così formato viene poi ossidato nella catena di trasporto degli elettroni.
Questo è un passaggio importante, perché la preferenza della Glutammico Deidrogenasi verso il NAD+ invece che per il NADP+ determina una minore presenza della molecola portatrice di potere riducente (NADPH), essenziale per la formazione e l’allungamento della catena di acido grasso in sintesi.
Con la presente trattazione non si vuole asserire che gli eccessi energetici, anche se di diversa natura, non inducano ugualmente processi di lipogenesi, ma si vuole sottolineare che i diversi rapporti tra i macronutrienti nell’ambito del medesimo introito calorico generano risposte differenti, perché sono differenti i “releasing ormonali” indotti dai nutrienti e differente è quindi anche la misura e la modalità con cui gli eccessi in questione sono trasformati in lipidi.
Tali differenze nelle risposte ormonali, indotte dall’introduzione di molecole di diversa natura, generano ancor più significative modificazioni nella costituzionalistica della composizione corporea – allorquando tale discorso lo si riferisca ad un contesto di regime ipocalorico.
Infatti il “Landmark Study” di Kekwick e Pawan ne rappresenta la prova scientifica. Lo studio sottopose un gruppo di pazienti a un regime ipocalorico (1000kcal) iperlipidico.
I soggetti decrementarono significativamente il loro peso corporeo. Quando lo stesso gruppo fu sottoposto allo stesso regime ipocalorico ma con assetto iperglucidico non vi fu alcun decremento del peso corporeo (Kekwick A. and G.L.S. Pawan. – “Metabolic study in human obesity with isocaloric diets high in fat, protein or carbohydrate”, in “Metabolism”, 1957, 6: 447-460).
Alla luce di ciò proteine e grasso corporeo non assume più il peso di una nozione veritiera ma più quello di un informazione errata che è figlia di saperi non chiari che tramandati nel tempo si sono solidificati nell’immaginario comune.
In conclusione, se il conteggio matematico calorico da un lato ci fornisce informazioni circa il nostro bilancio energetico, lo stesso non è in grado da solo di fornire spiegazioni univoche circa le modificazioni della composizione corporea.
E non deve essere preso in considerazione, quindi, come il solo fattore chiave determinante per la pianificazione di una programma alimentare, qualora l’obiettivo ambito sia il miglioramento della composizione corporea stessa – che risulta essere sensibilmente più correlato ad uno sbilanciamento del rapporto glucagone-insulina (in favore del primo) che non alla mera e sola sommatoria della resa energetica dei nutrienti introdotti.
Del dottor Francesco Casillo
BIBLIOGRAFIA
1)Catt K.J. – “An ABC of Endocrinology”, London, The Lancet, 1971.
2)Lane M.D., Moss J. E Polakis S.E. – “Acetyl Coenzyme A Carboxylase”, Curr. Top. Cell Regul., 8, 139-195, 1974.
3)Lowenstein J.M. – “Citrate and the Conversion of Carbohydrate into Fat”, p.61, in Goodwin T.W. (a cura di) – “Metabolic Roles of Citrate”, Academic, New York, 1968.
4)Tepperman J. – “Metabolic & Endocrine Physiology”, Chicago, Year Book Medical Publishers, 1973.



